بهترین روش برای لاغری چیست؟
همه گیر چاقی با وجود کمپین مداوم بهداشت عمومی برای کاهش دریافت انرژی (“کمتر خوردن”) و افزایش مصرف انرژی (“حرکت بیشتر”) همچنان ادامه دارد. یک توضیح برای این شکست این است که رویکرد فعلی، مبتنی بر مفهوم تعادل انرژی، به اندازه کافی مورد استقبال عموم قرار نگرفته است. احتمال دیگر این است که این رویکرد مبتنی بر یک پارادایم اشتباه است.
فرمول جدیدی از مدل تعادل انرژی (EBM)، مانند نسخههای قبلی، پرخوری (دریافت انرژی > مصرف انرژی) را علت اصلی چاقی در نظر میگیرد و تأکید بر «سیگنالهای پیچیده غدد درونریز، متابولیک و سیستم عصبی» است که مصرف غذا را کنترل میکند. سطح آگاهانه این مدل افزایش شیوع چاقی را به غذاهای ارزان، راحت، پر انرژی و «فوقفرآوریشده» سرشار از چربی و قند نسبت میدهد.
یک دیدگاه جایگزین، مدل کربوهیدرات-انسولین (CIM)، پیشنهاد میکند که پاسخهای هورمونی به کربوهیدراتهای بسیار فرآوریشده، تقسیم انرژی را به سمت رسوب در بافت چربی تغییر میدهد و کالری کمتری را برای نیازهای متابولیک بدن باقی میگذارد. بنابراین، افزایش چاقی باعث می شود که پرخوری برای جبران کالری های انباشته شده باشد. در اینجا، ما تضادهای قوی را در نحوه مشاهده پاتوفیزیولوژی چاقی توسط EBM و CIM برجسته میکنیم و کمبودهایی را در EBM در نظر میگیریم که مانع از آزمایش و اصلاح الگو میشود.
اصلاح این نقایص باید در اولویت قرار گیرد، زیرا برای حل مناقشات علمی طولانی مدت به یک تضاد پارادایم سازنده نیاز است و طراحی مدل های جدید را برای راهنمایی پیشگیری و درمان اطلاع رسانی می کند. با این وجود، اقدامات بهداشت عمومی نباید منتظر حل این بحث باشد، زیرا هر دو مدل کربوهیدرات های فرآوری شده را به عنوان محرک های اصلی چاقی هدف قرار می دهند.
کتابهای درسی، دستورالعملهای بهداشت عمومی و مواد آموزشی به بیمار، چاقی را بهعنوان یک اختلال تعادل انرژی تصور میکنند. یک بیانیه علمی از انجمن غدد درون ریز نتیجه می گیرد که “پاتوژنز چاقی شامل … تعادل انرژی مثبت پایدار (دریافت انرژی > مصرف انرژی)” و یک گزارش پانل متخصص از انجمن های بهداشت حرفه ای بزرگ بیان می کند، “برای دستیابی به کاهش وزن، کمبود انرژی لازم است» با این حال، این تکرار قانون اول ترمودینامیک، فیزیک را با پاتوفیزیولوژی ترکیب می کند افزایش ذخایر انرژی بدن – توده چربی، برای اهداف عملی – لزوماً تعادل انرژی مثبت را تشکیل می دهد. توضیح اولی توسط دومی توتولوژیک است.
واضح است که تب تنها در صورت وجود «توازن حرارتی» مثبت میتواند ایجاد شود، اما بیماران مبتلا به تب نیازی به آموزش در این مفهوم بدیهی ندارند و بررسیهای آکادمیک بیماری تب بر روی فیزیک گرما تمرکز نمیکند. هر فرضیه بیولوژیکی مفید پاتوژنز چاقی باید جهت علّی را در نظر بگیرد و قانون بقای انرژی بیش از یک احتمال را اجازه می دهد.
با توجه به دیدگاه مرسوم همانطور که در مدل تعادل انرژی (EBM) منعکس شده است، پرخوری باعث ایجاد چاقی مفرط می شود. درمان رژیم غذایی بر کاهش انرژی دریافتی برای کاهش ذخایر چربی بدن تمرکز دارد. یک دیدگاه جایگزین، مدل کربوهیدرات-انسولین (CIM)، مسیر مخالفی را مطرح میکند که افزایش چاقی باعث پرخوری میشود. هدف درمان رژیم غذایی کاهش ذخیره چربی بدن در درجه اول از طریق مکانیسم های هورمونی است که مستقیماً بر بافت چربی تأثیر می گذارد و در نتیجه تعادل انرژی منفی ایجاد می کند.
شکل 1 این تضاد اساسی را در مکانیسم ها نشان می دهد. (اصطلاحات «پرخوری» و «تعادل انرژی مثبت» به جای یکدیگر به معنای دریافت انرژی > مصرف انرژی استفاده میشوند. از آنجایی که بافت چربی محل ذخیره انرژی اولیه بدن است، افزایش توده چربی بدن نشان دهنده وجود تعادل انرژی مثبت است و بالعکس. ).
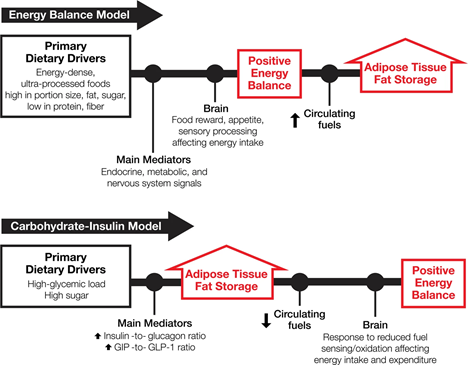
قانون اول ترمودینامیک حکم می کند که با افزایش ذخایر انرژی بدن باید تعادل انرژی مثبت وجود داشته باشد. تعادل انرژی مثبت در بالادست افزایش ذخیره چربی بافت چربی در مدل تعادل انرژی و پایین دست در مدل کربوهیدرات-انسولین است. (در نظر گرفته شده است که این نمایش ها شامل تمام تأثیرات محیطی و پاتوفیزیولوژیکی واسطه یا اصلاح کننده نیستند.).
اگرچه نسخههای این دو مدل تقریباً یک قرن است که با هم رقابت کردهاند، اما این بحث اخیراً تشدید شده است، همانطور که با فرمولبندیهای توسعهیافته CIM توسط لودویگ و همکاران و EBM توسط هال و همکاران در مجله آمریکایی تغذیه بالینی برجسته شده است. هدف این بررسی مقایسه ویژگیهای هر دو مدل، ارزیابی نقاط قوت شواهد پشتیبان، و مشخص کردن پیشرفتها در فرمول EBM برای ترویج تضاد پارادایم سازنده است.
مدل جدید تعادل انرژی – تمرکز بر مصرف غذا
هر دو مدل چاقی یک ویژگی مشترک دارند: تنظیم هموستاتیک فرضی یک پارامتر فیزیولوژیکی حیاتی برای ارتقای عملکرد مطلوب. در مدل EBM، وزن بدن (یا چربی بدن) متغیر تنظیم شده است، یک امکان با حمایت تکاملی: در حالی که چربی بدن کافی برای بقا در زمان کمبود غذا مورد نیاز است، چربی بیش از حد ممکن است خطر شکار را افزایش دهد.
EBM جدید هال و همکاران پیشنهاد می کند که مغز مصرف غذا را برای تنظیم وزن بدن از طریق سیگنال های پیچیده غدد درون ریز، متابولیک و سیستم عصبی که در پاسخ به نیازهای انرژی پویای بدن و همچنین تأثیرات محیطی عمل می کنند، کنترل می کند. این سیستم کنترل بر «پاداش، اشتها، [و] پردازش حسی» متمرکز است که شامل «برتری، خواستن و انگیزهای است که در درجه اول در زیر آگاهی خودآگاه ما عمل میکنند».
چاقی ناشی از افزایش در دسترس بودن و بازاریابی طیف گسترده ای از غذاهای ارزان، راحت، پر انرژی و فوق فرآوری شده است که از نظر اندازه، چربی و قند بالا و پروتئین و فیبر کم هستند. این قرار گرفتن در معرض باعث پرخوری می شود و انرژی اضافی به چربی بدن تبدیل می شود.
فرمول های قبلی به طور مشخص هر دو جزء تعادل انرژی را در هماهنگی در نظر می گرفتند. EBM هال و همکاران با این فرمولبندیها با تمرکز اولیه بر کنترل دریافت غذا و توجه کمتر به مصرف انرژی متفاوت است. این EBM جدید نشان میدهد، و بررسیهای مرتبط به صراحت بیان میکنند که تمام کالریها از نظر متابولیکی در مدل یکسان هستند. به عنوان مثال، هال و گوا اظهار می دارند که “برای همه اهداف عملی، “یک کالری یک کالری است” در مورد تفاوت های چربی بدن و مصرف انرژی بین رژیم های غذایی ایزوکالری کنترل شده که در نسبت کربوهیدرات به چربی متفاوت است.
با اذعان به اینکه ترکیب رژیم غذایی بر نرخ اکسیداسیون درشت مغذی های مربوطه تأثیر می گذارد، EBM معتقد است که رژیم غذایی در نهایت با افزایش کل انرژی دریافتی، رسوب چربی را هدایت می کند، نه از طریق تأثیرات مستقل از کالری بر پارتیشن بندی بستر.
مدل کربوهیدرات-انسولین – یک مورد خاص از پارادایم متابولیک
CIM نشان دهنده یک الگوی متضاد با منشأ در اوایل قرن بیستم است که عرضه سوخت های متابولیک در خون (به عنوان نماینده اکسیداسیون سوخت) را پارامتر تنظیم شده در نظر می گیرد. در حالی که چربی کافی بدن ممکن است به بقا در طول قحطی کمک کند، دسترسی به سوختهای متابولیک برای بقای فوری، با توجه به وابستگی تمام بافتها، و بهویژه مغز، به یک منبع سوخت مداوم، لازم است.
CIM پیشنهاد می کند که یک رژیم غذایی با بار گلیسمی بالا (GL) رژیمی با مقادیر زیادی کربوهیدرات های سریع هضم (به عنوان مثال، شکر آزاد، غلات فرآوری شده، بیشتر سبزیجات نشاسته ای) باعث ایجاد پاسخ های هورمونی می شود که از تجزیه چربی (لیپولیز) جلوگیری می کند و باعث رسوب چربی می شود.
در بافت چربی همانطور که اخیراً توضیح داده شد، مصرف یک وعده غذایی با GL بالا باعث تولید نسبت بالایی از انسولین به ترشح گلوکاگون و ترشح GIP به GLP-1 می شود. این پروفایل هورمونی بسیار آنابولیک، پارتیشن بندی سوبسترا را به سمت رسوب تغییر می دهد و انرژی کمتری را برای بافت های فعال متابولیکی از جمله مغز، به ویژه در اواخر دوره پس از غذا، باقی می گذارد. مغز با فعال کردن مسیرهای کنترل گرسنگی و سایر واکنشهای اشتهاآور برای ارتقای دریافت انرژی، به این حالت متابولیک پاسخ میدهد.
اگر فردی با محدود کردن غذا در برابر میل به غذا خوردن مقاومت کند، سوختهای متابولیک از طریق کاهش مصرف انرژی حفظ میشوند که به صورت خستگی (منجر به رفتار بیتحرکی)، کاهش گرمازایی فعالیت بدون ورزش، افزایش کارایی عضلانی و مکانیسمهای دیگر ظاهر میشود. بدون محدودیت کالری علاوه بر توانایی بیشتر افراد برای حفظ چربی، تجمع چربی به دلیل تقسیم مداوم انرژی به بافت چربی حاصل می شود. بنابراین، CIM توضیحی برای اثربخشی ضعیف رژیمهای غذایی با کالری محدود علاوه برعدم پایبندی، به دلیل تأثیرات لذتبخش و پاداش ارائه میدهد.
علاوه برGL، CIM یک چارچوب مفهومی برای درک اینکه چگونه سایر عوامل رژیمی، رفتارها و قرار گرفتن در معرض محیطی ممکن است بر وزن بدن از طریق مکانیسمهای متابولیک، به جای تأثیرات اولیه بر دریافت یا مصرف انرژی تأثیر بگذارند، ارائه میکند. اینها شامل فروکتوز، مقدار پروتئین، نوع اسید چرب، فیبر، ترتیب غذا در وعده غذایی، زمان غذا خوردن، فعالیت بدنی و مواد افزودنی و آلاینده های مختل کننده غدد درون ریز است.
CIM همچنین یک تعامل فنوتیپ رژیم غذایی را فرض می کند، به طوری که افراد با ترشح انسولین درون زا بالا، اختلالات در هموستاز گلوکز و حساسیت بالا به سرکوب لیپولیز چربی با واسطه انسولین، در برابر اثرات متابولیکی نامطلوب رژیم غذایی با GL بالا حساس هستند و به طور بالقوه برخی از ناهمگونی های مشخص را در پاسخ به رژیم های کاهش وزن متمرکز بر درشت مغذی ها توضیح می دهد.
این دیدگاه از پاتوفیزیولوژی با ایجاد اشکال رایج چاقی مطابقت دارد. یک جابجایی کوچک در پارتیشن بندی بستر به نفع ذخیره سازی چربی باعث افزایش وزن آهسته اما پیشرونده می شود، تا زمانی که مقاومت به انسولین بافت چربی به میزان کافی ایجاد شود. مقاومت به انسولین بافت چربی ترشح بیش از حد انسولین در یک رژیم غذایی با GL بالا را متعادل می کند، که منجر به کاهش وزن می شود، اما به قیمت رسوب نابجای چربی و اختلال عملکرد متابولیک سیستمیک، که مطابق با فرضیه انبساط پذیری بافت چربی است. این فرمول توسعه یافته مکانیسم های دقیق و فرضیه های قابل آزمایش متعددی را برای اطلاع رسانی به تحقیق ارائه می دهد.

شواهد مربوط به دو مدل
سیر طبیعی چاقی، که معمولاً طی سالها تا دههها ایجاد میشود، شامل ذخیره بیش از حد 1 تا 2 گرم چربی در روز به طور متوسط است که برای اندازهگیری در مطالعات کوتاهمدت تغذیه متابولیک (یعنی ≤2 هفته) بسیار کوچک است. در حالی که این اثر میتواند در کارآزماییهای سرپایی طولانیمدت و مطالعات مشاهدهای قابل مشاهده باشد، استنتاج از این دادهها ممکن است با پایبندی ضعیف به رژیمهای غذایی آزمایشی و گیجکننده محدود شود. علاوه بر این، مطالعات کمی بر دوران کودکی، مرحله پویای رشد چاقی تمرکز کرده اند.
اگرچه مطالعات حیوانی می تواند مکانیسم ها را روشن کند، تعمیم آنها به انسان همچنان مشکل ساز است. به این دلایل، مقالات گسترده در مورد پاتوژنز چاقی را می توان به طور انتخابی برای بیان نکات متضاد مورد استناد قرار داد، همانطور که هر طرف این بحث از طرف دیگر ادعا کرده است.
در این بخش، هدف ما ارائه یک بررسی جامع از مقالات نیست، بلکه با توجه به محدودیتهای طراحی مطالعه، اختلافات اصلی با هال و همکاران را برجسته میکنیم. جدول 1 ویژگی های کلیدی متمایز کننده مدل ها را برای تسهیل این ارزیابی خلاصه می کند. بررسی های قبلی طیف وسیعی از دیدگاه ها را برای و علیه نسخه های قبلی EBM ارائه می دهد.
| ویژگی های متمایز | مدل تعادل انرژی | مدل کربوهیدرات-انسولین |
| جهت علتی | تعادل انرژی مثبت باعث رسوب چربی می شود | رسوب چربی باعث تعادل انرژی مثبت می شود |
| متغیر تنظیم شده | انواع مختلف: مصرف غذا، تعادل انرژی، وزن بدن یا توده چربی | نرخ اکسیداسیون سوخت متابولیک در اندام های حیاتیa |
| محرک های اصلی رژیم غذایی همه گیر | انواع مختلف: مصرف چربی بالا؛ غذاهای پر انرژی و بسیار خوش طعم؛ غذاهای ارزان و راحت فوق فرآوری شده؛ قند بالا، چربی، نمک با پروتئین کم، فیبر | کربوهیدرات های با بار گلیسمی بالا، فروکتوز |
| اثرات مستقل از کالری رژیم غذایی بر مصرف انرژی | خیر | بله |
| اثرات رژیم غذایی مستقل از کالری بر پارتیشن بندی بستر یا رسوب چربی | خیر | بله |
| کاهش سوختهای متابولیک در گردش در اواخر دوره پس از غذا در رژیم غذایی با GL بالا در مقابل GL پایین | خیر | بله |
| اصلاح اثر با ترشح انسولینb | مشخص نشده است | بله |
مدل تعادل انرژی و مدل کربوهیدرات-انسولین هر دو تأثیرات پیچیده و چند عاملی را بر وزن بدن مرتبط با ژنتیک، رفتار و محیط تشخیص میدهند. این ویژگیهای متمایز، مبنایی برای مقایسه اعتبار مدل در تحقیقات فرضیهمحور فراهم میکنند. توجه داشته باشید که مدل ها لزوماً متقابل نیستند. شواهدی در حمایت از هر دو مدل ممکن است در اشکال مختلف چاقی و تحت شرایط تجربی متفاوت یافت شود.
- غلظت سوخت متابولیک در خون یک نماینده برای نرخ اکسیداسیون در اندام های حیاتی (مغز، کبد) است. غلظت سوخت متابولیک به طور کلی نرخ اکسیداسیون را در مرحله پویای توسعه چاقی منعکس می کند. اینها ممکن است در طول فاز جبرانی با ایجاد مقاومت به انسولین جدا شوند.
- افراد با ترشح انسولین بالا یا پایین فرض میکنند که واکنشهای نامطلوبتری به رژیم غذایی با بار گلیسمی بالا دارند.
تحقیقات حیوانی
اگرچه جوندگان و انسان ها برای خوردن یک رژیم غذایی تکامل نیافته اند، تحقیقات حیوانی تجربی در این بحث مورد توجه قرار گرفته است. هال و همکاران به عنوان مدرکی علیه CIM این مشاهدات را ارائه کردند که رژیم غذایی 70 درصد کربوهیدرات و 10 درصد چربی از جوندگان در برابر چاقی محافظت می کند و رژیمی با 20 درصد کربوهیدرات و 60 درصد چربی بیشترین افزایش وزن را در برخی شرایط تجربی ایجاد می کند.
به طور مشابه، یک مطالعه اخیر با 5 سویه موش به این نتیجه رسید که افزایش چربی رژیم غذایی، اما نه کربوهیدرات یا پروتئین، با تغییرات بیشتر در مصرف غذا و وزن بدن مرتبط است. با این حال، توردف و الیس دریافتند که رژیم غذایی جوندگان با مقادیر مساوی (بر اساس انرژی) کربوهیدرات و چربی بیشتر چاقزا هستند و انحراف در هر جهت باعث کاهش و یا افزایش وزن میشود. کندی و همکاران با افزودن به این ناهمگونی به این نتیجه رسیدند که رژیم غذایی با کربوهیدرات بسیار کم (با محتوای پروتئین کمتر) در موش “یک حالت متابولیک منحصر به فرد را با کاهش وزن ایجاد می کند”.
بدیهی است که با توجه به محدودیتهای توصیف شده مربوط به ویژگیهای خاص سویههای همخون، مخدوشکننده از نظر قرار گرفتن در معرض رژیم غذایی کنترلنشده و نیازهای تغذیهای متفاوت جوندگان و انسانها این تحقیق باید با احتیاط به انسان تعمیم داده شود. به عنوان مثال، چربی اشباع شده و شکر اغلب بیشترین کالری را در رژیم غذایی جوندگان پرچرب تشکیل می دهند، ترکیبی که باعث التهاب هیپوتالاموس و مقاومت سیستمیک به انسولین می شود.
با بررسی مستقیم جهت علتی می توان از این مسائل روش شناختی اجتناب کرد. در حالی که پاسخهای هورمونی به درشت مغذیها ممکن است در میان گونهها به دلیل واگرایی تکاملی متفاوت باشد، مکانیسمهای بیولوژیکی مؤثر بر ذخیرهسازی چربی به شدت حفظ شدهاند و تعمیم بالقوه مطالعات جوندگان به انسان را افزایش میدهند. در EBM، رژیم غذایی با افزایش مصرف غذا باعث رسوب چربی می شود. بنابراین، هنگامی که حیواناتی که دارای رژیم غذایی چاق هستند، با یک رژیم غذایی کنترل ایزوکالوریک به همزادان تغذیه می شوند، با اطمینان از دریافت انرژی یکسان، تأثیرات روی ترکیب بدن باید یکسان باشد.
این پیش بینی اغلب با شکست مواجه می شود. موشهای پترو و همکاران با رژیمهای غذایی 58 درصد در مقابل 11 درصد چربی به مدت 11 هفته تغذیه کردند و چربی بیشتری را در گروه پرچرب مشاهده کردند (24.1 در مقابل 18.5 درصد)، مطابق با یافتههای دیگر. اثرات مشابهی مستقل از کالری در رژیم های غذایی با قند بالا مشاهده شده است. اگرچه میتوان مفاهیم این دادهها را با این استدلال که جوندگان مستعدتر به چنین اثرات متابولیکی هستند به چالش کشید، این استدلال اعتبار مطالعات درشت مغذیهای جوندگان برای درک چاقی انسان را در وهله اول تضعیف میکند.
مطالعات شاخص گلیسمی (GI) راه دیگری را برای دور زدن تفاوتهای خاص گونهها در متابولیسم درشت مغذیها ارائه میدهد. در یک خط تحقیقاتی شامل چندین گونه از جوندگان، اثرات GI با جایگزینی نوع نشاسته، کنترل درشت مغذیها، چربی اشباع، قند و ریز مغذیها مورد بررسی قرار گرفت.
این مطالعات تغییرات زیر را در میان حیواناتی که جیرههای با GI بالا در مقایسه با GI پایین مصرف میکنند نشان میدهد: هیپرانسولینمی، تغییر در تقسیمبندی بستر به نفع رسوب چربی، کاهش مصرف انرژی، افزایش چربی و افزایش وزن – همه قبل از افزایش انرژی دریافتی اتفاق افتادند. هنگامی که انرژی دریافتی برای جلوگیری از افزایش وزن محدود شد، گروه با GI بالا همچنان ترکیب بدنی غیرعادی داشتند.
علیرغم دریافت کالری کمتر، این حیوانات به ازای بافت های لاغر بدن، چربی بدن بیشتری داشتند. اگرچه مکانیسمهای متعدد (به عنوان مثال، میکروبیوم روده) ممکن است واسطه این اثرات باشند، اما با فرض اساسی EBM که ترکیب رژیم غذایی هیچ تأثیر مستقل از کالری بر رسوب چربی ندارد، در تضاد است.
در نهایت، هال و همکاران، مطالعات مربوط به عملکرد انسولین را به عنوان غیر تبعیضآمیز رد میکنند، اما اینها فرصت دیگری را برای آزمایش پیشبینیهای مدل به صورت مو به مو فراهم میکنند. در CIM، ترشح انسولین بیشتر از طریق مکانیسم های محیطی مستقیم باعث ذخیره چربی می شود. به نظر میرسد EBM با تمرکز بر فعالیتهای مرکزی هورمونها، با توجه به اثرات بیاشتهایی انسولین در مغز، خلاف آن را پیشبینی میکند.
این مطالعات در مورد چاقی، شامل تجویز مزمن انسولین و مدل های ژنتیکی کاهش ترشح انسولین، از CIM پشتیبانی می کند. کم اهمیت جلوه دادن اهمیت این یافته ها – اینکه اعمال مستقل از کالری محیطی بر اقدامات وابسته به کالری مرکزی غالب است – خطر ایجاد یک EBM را به قدری عمومی می کند که غیرقابل آزمایش باشد، به خصوص که هال و همکاران اثرات بی اشتهایی مرکزی انسولین را پس از تزریق بینی در انسان به عنوان شواهد علیه CIM تفسیر می کنند.
مغز و ژنتیک
همانطور که هال و همکاران می گویند، «سیستم های عصبی برای کنترل دریافت انرژی تکامل یافته اند،» مغز تقریباً تمام جنبه های متابولیسم، از جمله متابولیسم گلوکز را نیز کنترل می کند، همانطور که کلود برنارد در دهه 1850 توصیف کرد. در واقع، اثرات ترکیب رژیم غذایی بر ترکیب بدن منطبق با CIM معمولاً در بین مدلهای حیوانی چاقی، همانطور که در جدول 2 نشان داده شده است، آشکار میشود.
با محدودیت انرژی دریافتی به سطوحی در سطح یا پایینتر از سطوح کنترل، افزایش چربی در مدلهای تجربی مشاهده شده است که تأثیرگذار است. مسیرهای مغزی متعددی که تصور میشود واسطهی دریافت غذا هستند، وجود اعمال متابولیک محیطی هورمونهای فرضی «گرسنگی» یا «سیری» را نشان میدهند. در برخی از این مدل ها، چاقی بیش از حد به طور خود به خود بدون افزایش مصرف غذا یا وزن بدن ایجاد می شود. به نظر میرسد این یافتهها با تفسیر رایج مطالعات ژنتیکی انسانی که شیوع بیشتر پلیمورفیسمهای مرتبط با چاقی در مغز در مقابل سلولهای چربی را به عنوان شواهدی برای EBM نسبت میدهد، مغایرت دارد.
جدول 2 رابطه بین انرژی دریافتی و چاقی در مدل های حیوانی منتخب چاقی.
| مدل حیوانی | ↑ چاقی بدون (یا قبل) ↑ وزن | ↑ چاقی بدون (یا قبل) ↑ دریافت انرژی | ↑ چاقی با کنترل انرژی دریافتیa |
| جهت علّی را در CIM نشان می دهد | |||
| رژیم غذایی با شاخص گلیسمی بالا | + | ||
| کمبود گیرنده MC3 | + | ||
| جهت علی را در CIM پیشنهاد می کند | |||
| فرسایش نورون AgRP (غذا منظم) | + | ||
| کمبود CHOP | + | ||
| کمبود GABA | + | ||
| رژیم غذایی با قند بالا (فروکتوز).b | + | ||
| ضایعه مغزی مونو سدیم گلوتامات | + | ||
| کمبود MRAP2 | + | ||
| آسیب هیپوتالاموس بطنیb | + | ||
| مطابق با جهت علی در CIM | |||
| AgRP مازاد | + | ||
| کمبود گیرنده بومبزین زیرگروه 3 | + | ||
| رژیم غذایی پرچرب | + | ||
| انسولین اضافی | + | ||
| کمبود لپتین | + | ||
| MCH بیش از حدc | + | ||
| کمبود گیرنده MC4 | + | ||
| نوروپپتید Y بیش از حد | + | ||
| تحریک گیرنده شبه مواد افیونی 1 | + | ||
افزایش چربی قبل از افزایش وزن نشان دهنده جهت علّی در CIM و در تضاد با آن در EBM است. افزایش چاقی بدون (یا قبل از) افزایش مصرف انرژی نشان دهنده جهت علّی در CIM است و تمایل به مخالفت با آن در EBM دارد. افزایش چاقی با کنترل دریافت انرژی با جهت علّی در CIM سازگار است، اما آن را در EBM رد نمی کند. (N.B.، تغذیه جفتی یا سایر کنترلها برای ارزیابی وجود نقص متابولیک اولیه در بسیاری از مدلهای حیوانی آزمایشی انجام نشده است.) اگرچه در اینجا بررسی نشده است، مدلهای حیوانی لاغری، مانند انسولین ژنتیکی، اثرات متابولیکی مطابق با CIM را نشان میدهند.
(C/EBP) =CHOP CCAAT/enhancer-binding proteinپروتئین همولوگ CCAAT/پروتئین پیوند دهنده تقویت کننده ،
MCH = melanin concentration hormone = هورمون غلظت ملانین
MC3 ملانوکورتین-3،
MC4 ملانوکورتین-4،
melanocortin 2 receptor accessory protein 2 =MRAP2 2 =پروتئین جانبی گیرنده ملانوکورتین 2
a افزایش در مصرف انرژی که قبل از افزایش چاقی مشاهده شده است، مسیر علی مشخص شده توسط CIM را رد نمی کند، به دلیل عدم دقت اندازه گیری ترکیب بدن برای تغییرات کوچک در توده چربی. روابط علّی در این مورد را می توان با تغذیه جفتی یا روش های دیگر برای کنترل مصرف انرژی مورد بررسی قرار داد.
b یافته ها بر اساس پروتکل تجربی متفاوت است.
c استقلال دریافت انرژی با نقص متابولیک (به عنوان مثال، پارتیشن بندی زیرلایه تغییر یافته، کاهش نیاز انرژی در طول توسعه چاقی) مشهود است.
واضح است که عوامل ژنتیکی بر خطر چاقی انسان تأثیر میگذارند و وراثتپذیری BMI بر اساس توالییابی کل ژنوم 30 درصد تخمین زده میشود. تنها یک جزء کوچک از این وراثتپذیری را میتوان با تغییرات رایج شناخته شده در حدود 290 پلیمورفیسم تک نوکلئوتیدی توضیح داد و پیامدهای فیزیولوژیکی بیشتر این پلیمورفیسمها ناشناخته باقی میماند. در برخی موارد) به عنوان مثال (MC4Rتغییرات رایج نزدیک به ژنهایی که باعث چاقی تک ژنی میشوند، اهمیت حیاتی سیستم عصبی مرکزی را نشان میدهد – اگرچه اینها مسیرهای سازگار با CIM را رد نمیکنند (جدول 2).
برخی از ژن های دخیل به طور گسترده در مغز بیان می شوند و برخی دیگر در همه جا بیان می شوند) به عنوان مثال .(FTO برخی دیگر به طور برجستهتری در خارج از مغز بیان میشوند )مانند MSX1، TMEM18، SEC16B، (ADCY3 . در واقع، تجزیه و تحلیل مسیر نشان داد که حساسیت ژنتیکی به چاقی میتواند شامل «ترشح/عملکرد انسولین، متابولیسم انرژی، زیستشناسی لیپیدها و آدیپوژنز» باشد.
برای پلی مورفیسم که توسط هال و همکاران به عنوان شواهدی علیه CIM ذکر شده است، تفسیرهای جایگزین قابل اجرا هستند. به عنوان مثال، جهش های هموزیگوت در ATGL که منجر به لیپولیز معیوب می شود، به نظر نمی رسد خطر چاقی را افزایش دهد. با این حال، این جهش همچنین لیپوژنز را مختل می کند و در نتیجه نه تنها تحرک چربی کمتری دارد، بلکه ذخیره چربی نیز کمتر می شود. همانطور که شرایبر و همکاران نتیجه می گیرند، “وابستگی متقابل کاتابولیسم و سنتز لیپیدها توضیح منطقی برای عدم چاقی در موش ها و انسان های دارای کمبود ATGL ارائه می دهد.” در حالی که آلل های ژن FTO با اشتها یا مصرف غذا مرتبط است، این مشاهدات هیچ اطلاعاتی در مورد مسیرهای متابولیک یا جهت علتی ارائه نمی دهد.
بنابراین، مطالعات ژنتیکی مسیرهای مربوط به چاقی را نشان می دهد که در داخل و خارج از مغز عمل می کنند. در بسیاری از موارد، این موارد با CIM مطابقت دارند. در مجموع، با توجه به نقش مغز در کنترل مصرف غذا و متابولیسم انرژی و ارتباط بین بدن و مغز از طریق سیگنالهای عصبی، متابولیک و هورمونی، دادههای بیان ژنتیکی به طور قطعی بین این دو مدل تفاوت قائل نمیشوند.
اپیدمیولوژی
اگرچه محدودیتهای طراحی مانع از آزمایش مستقیم مکانیسمهای علتی در EBM در مقابل CIM با تحقیقات مشاهدهای میشود، اما اگر با احتیاط لازم تفسیر شوند، این مطالعات همچنان میتوانند آموزنده باشند. هال و همکاران بیان میکنند که «شواهدی که نشان دهد مصرف کربوهیدرات تفاوتهای وزن بدن را در بین کشورها توضیح میدهد، وجود ندارد»، اما این مقایسههای زیستمحیطی برای متغیرهایی مانند وزن بدن ارزش کمی دارند.
به عنوان مثال، کشورهایی که کربوهیدرات دریافتی بالایی دارند، فقیر هستند و بخش قابل توجهی از جمعیت آن دچار سوءتغذیه و مشغول به کشاورزی معیشتی هستند. علاوه بر این، هال و همکاران. نادیده گرفتن تاریخچه طولانی و غنی از مشاهدات مربوط به پیدایش اختلالات مزمن رایج، چاقی در میان آنها، و تغییر تغذیه در کل جمعیت که معمولاً شامل افزایش مصرف غلات بسیار تصفیه شده، شکر و نوشیدنی های شیرین می شود.
در ایالات متحده، BMI به سرعت از سال 1970 تا 2000 همزمان با افزایش قابل توجه در مصرف غلات تصفیه شده، شکر و کربوهیدرات کل افزایش یافت. اگرچه ممکن است این روندهای سکولار با تغییرات در فعالیت بدنی و سایر رفتارهای مرتبط مخدوش شوند.
مطالعات کوهورت آینده نگر توانایی بیشتری برای کنترل عوامل مداخله گر، به ویژه از جمله وضعیت اجتماعی-اقتصادی فراهم می کند، اگرچه ممکن است مخدوش کننده باقیمانده باقی بماند. علاوه بر این، وزن بدن و سایر معیارهای چاقی به ویژه در معرض علیت معکوس هستند (تمایل افراد به تغییر رژیم غذایی خود به عنوان یک نتیجه، و نه دلیل افزایش وزن یا چاقی). علاوه بر این، طرح معمولی آیندهنگر که رژیم غذایی پایه را با تغییر وزن آینده مقایسه میکند، تغییرات قبلی را که تا زمان ارزیابی رژیم غذایی به حالت ثابت رسیدهاند، تشخیص نمیدهد.
در این شرایط، سوگیری نسبت به تداعیهای پوچ ممکن است رخ دهد. بنابراین، فقدان ارتباط ثابت شامل GI و GL در مطالعات کوهورت به سختی قابل تفسیر است. برای شبیه سازی بهتر یک مطالعه مداخله ای، رابطه تغییر رژیم غذایی با تغییر وزن در طول زمان قابل بررسی است. در چنین تحلیلهایی، مصرف بیشتر غلات تصفیهشده، محصولات سیبزمینی، و نوشیدنیهای شیرینشده با قند – که عوامل اصلی GL بالا هستند – با افزایش وزن بیشتر در سه گروه بزرگ پس از تعدیل گسترده برای عوامل بالقوه مخدوشکننده رژیم غذایی و سبک زندگی همراه بود. (گوشت های قرمز و فرآوری شده نیز در این مطالعات با افزایش وزن بیشتر مرتبط بودند).
هال و همکاران نتیجه میگیرند که دادههای اپیدمیولوژیک، «منطبق با EBM، انواع محرکهای غذایی بالقوه دریافت کالری اضافی را نشان میدهد…» با این حال، مظفریان سؤالات جدیدی را در مورد این مفهومسازی، حداقل در رابطه با مرحله فعلی همهگیری چاقی مطرح میکند.
در ایالات متحده امریکا. مظفریان بر اساس بررسیهای ملی نشان میدهد که انرژی دریافتی از سال 2000 کاهش یافته است و فعالیت فیزیکی حتی با ادامه افزایش نرخ چاقی، به طور متوسط افزایش یافته است. (به دلیل افزایش نامتناسب دور کمر در زنان، روند چاقی که توسط BMI ارزیابی میشود ممکن است میزان پیشرفت همهگیری از سال 2000 را دست کم بگیرد). او استدلال می کند که این روندها نیازمند در نظر گرفتن توضیحات علتی جایگزین، از جمله مواردی است که شامل اختلال عملکرد متابولیک است.
آزمایشات بالینی
متاآنالیز اخیر کارآزماییهای رفتاری، هیچ تفاوتی را در کاهش وزن طولانیمدت در بین رژیمهای غذایی متمرکز بر درشت مغذیها گزارش نکرد، همانطور که هال و همکاران ذکر کردند، در حالی که سایر متاآنالیزها که رژیمهای غذایی کم کربوهیدرات را در مقایسه با رژیمهای پر کربوهیدرات مقایسه میکنند، مزیت قابلتوجهی را برای رژیمهای اول نشان میدهند. با این حال، تفسیر این شواهد تمایل دارد که اثربخشی را با اجرای رفتاری ترکیب کند. اکثر کارآزماییهای کاهش وزن رفتاری فاقد شدت مداخله کافی برای به دست آوردن تضادهای قوی در دریافت درشت مغذیها بین گروهها هستند و تفاوتهای اولیه در کاهش وزن بین گروهها به سرعت کاهش مییابد.
حفظ تغییر رژیم غذایی در محیط غذایی مدرن می تواند دشوار باشد، اما این چالش غیر قابل حل نیست. با دانش بهتر از اثربخشی، می توان مداخلات رفتاری و محیطی قدرتمندتری را برای تسهیل پایبندی طولانی مدت طراحی کرد. در میان معدود کارآزماییهایی که از مداخلات فشرده استفاده میکردند (به عنوان مثال، تامین غذای جزئی)، کاهش وزن در رژیمهای غذایی با GL پایین در مقایسه با طول مدت پروتکلها بیشتر بود.
محدودیتهای کارآزماییهای زندگی آزاد را میتوان در اصل با کارآزماییهای بخش متابولیک که کنترل دقیقی بر پایبندی و عوامل مخدوشکننده دارند، دور زد. با این حال، به دلیل هزینهها و چالشهای لجستیکی، این آزمایشها معمولاً کوتاه مدت هستند و نگرانیهایی را برای استنباط بیاساس که شامل اثرات مزمن میشود، افزایش میدهد. نیاز به آزمایشات حداقل چند ماهه توسط هال تشخیص داده شد، که مشاهده کرد: حتی تفاوتهای کوچک در مصرف انرژی و تعادل درشت مغذیها از نظر تئوری میتواند منجر به تفاوتهای قابلتوجهی در وزن و ترکیب بدن شود، اگر رژیمها در دورههای طولانی حفظ شوند.
یک تفاوت ۱۰۰ کیلوکالری در روز در مصرف انرژی به تنهایی می تواند منجر به عدم تعادل اولیه چربی بدن در حدود ۱۰ گرم در روز شود. با استفاده از روش های فعلی ترکیب بدن، تشخیص چنین تفاوتی در چربی بدن به یک دوره ثابت حدود 100 روزه نیاز دارد. با این حال، این احتمال نیاز به بررسی بیشتر دارد.
علاوه بر این، سازگاری متابولیک با تغییرات درشت مغذی ممکن است به چند هفته تا چند ماه نیاز داشته باشد. یک متاآنالیز اخیر، مصرف انرژی کل بالاتر، با ناهمگنی کم را در میان مطالعاتی به مدت 2.5 هفته در مقایسه با رژیمهای کم کربوهیدرات در مقایسه با رژیمهای پر کربوهیدرات گزارش کرد.
هیچ اثر رژیم غذایی معنیداری در مطالعات کمتر از 2.5 هفته، با ناهمگنی قابلتوجه، که نگرانیها را در مورد ارزش آزمایشهای کوتاه تقویت میکند، مشهود نبود. تنظیم مصنوعی یک بخش متابولیک نیز ممکن است بر رفتار خوردن مستقل از مکانیسمهای فیزیولوژیکی تأثیر بگذارد.
هال و همکاران دو کارآزمایی بستری 2 هفته ای را به عنوان ناسازگار با CIM تفسیر می کنند. در یکی از این کارآزماییها، مصرف انرژی آزادانه 500 کیلوکالری در روز در رژیم غذایی «فوقفرآوریشده» در مقایسه با رژیم «فرآورینشده» بیشتر بود. با این حال، این تفاوت به سرعت با شیب 25- کیلوکالری در روز در رژیم غذایی “فوق فرآوری شده” کاهش یافت، که نشان می دهد این اثر می تواند پس از 2 هفته دیگر خاموش شود.
علاوه بر این، تفاوت اولیه در دریافت انرژی کاملاً به تفاوت زیاد در چگالی انرژی نسبت داده میشود، عاملی که بر مصرف کوتاهمدت، اما نه مزمن تأثیر میگذارد (به زیر مراجعه کنید). مربوط به این نگرانی، ناتوانی در تشخیص مکانیسم های مهم درشت مغذی است. در حالی که میزان فرآوری غذا تا حد زیادی بر سرعت هضم، پاسخ هورمونی و اثرات سلامتی غذاهای پر کربوهیدرات تأثیر میگذارد، پردازش اهمیت فیزیولوژیکی کمتری برای غذاهای پرچرب و پرپروتئین دارد (جدول 3) – به این معنی که اثرات نامطلوب مواد غذایی فوقالعاده غذاهای فرآوری شده را می توان با CIM بهتر از EBM توضیح داد.
جدول 3 اثرات فرآوری مواد غذایی وابسته به درشت مغذی ها
| ساختار غذای بومی | ساختار غذا مختل شده است | اثرات عمده سلامت وابسته به پردازش |
| غذاهای پر کربوهیدرات | ||
| دانه گندم | نان سفید | + |
| جو دوسر پوست کنده یا خرد شده | جوی دوسر فوری | + |
| سیب | آب سیب | + |
| غذای پرچرب | ||
| زیتون | روغن زیتون | – |
| بادام زمینی | کره بادام زمینی | – |
| آووکادو | گواکاموله(یک ظرف آووکادوی له شده مخلوط با پیاز خرد شده، گوجه فرنگی، فلفل چیلی و چاشنی) | – |
| دانه های کنجد | ارده | – |
| کاکائو | شکلات تلخ | – |
| خامه غلیظ | خامه زده شده و فرم گرفته | – |
| غذاهای پرپروتئین | ||
| بوقلمون | بوقلمون چرخ شده | – |
| سویا | توفو | – |
| تخم مرغ آبپز | تخم مرغ نیمرو | – |
ساختار سلولی گیاهان، از جمله سلولز و الیاف محلول، از کربوهیدرات های درونی در برابر هضم آنزیمی و انتشار به دیواره روده محافظت می کند. فرآوری گسترده مواد غذایی این ساختار را مختل می کند و در نتیجه نشاسته و قندهای بدون سلولی با افزایش قابل توجه GL و اثرات نامطلوب سلامتی همراه است. با سرعت هضم ذاتاً کندتر، غذاهای پرچرب و پروتئین بالا کمتر تحت تأثیر فرآوری غذا قرار می گیرند. (اگرچه گاهی اوقات با غذاهای حیوانی طراحی می شود، رژیم غذایی با GL پایین ممکن است گیاهخواری یا گیاهخواری باشد، همانطور که بیشتر این نمونه ها نشان می دهند).
الگوی مشابهی از کاهش اثر، که به طور بالقوه مربوط به سازگاری متابولیک و چگالی انرژی است، در دومین کارآزمایی بخش 2 هفتهای مشاهده شد که رژیمهای غذایی کمچرب و کم کربوهیدرات را مقایسه کرد. در انتظار تحقیقات قطعی، عاقلانه به نظر می رسد که فرض نکنیم این اثرات کاهشی در دراز مدت بر وزن بدن تثبیت می شود و بر وزن بدن تأثیر می گذارد.
داروها
نقش غالب انسولین در فیزیولوژی سلول های چربی، از جمله لیپوژنز و لیپولیز، به مدت یک دهه شناخته شده است. در بیماران مبتلا به دیابت، انسولین و داروهایی که ترشح انسولین را افزایش می دهند یا بر متابولیسم بافت چربی اثر می گذارند، باعث افزایش وزن می شوند.
برخی از این اثرات ممکن است شامل مکانیسمهای دیگر سازگار با EBM مانند کاهش گلیکوزوری باشد. با این حال، کاهش وزن ناشی از داروهایی که ترشح کمتری دارند، نشان میدهد که اثر انسولین روی ذخیرهسازی چربی که در جوندگان مشاهده میشود در انسان نیز رخ میدهد. به عنوان مثال، مهارکنندههای آلفا گلوکوزیداز که پاسخ گلیسمی به کربوهیدرات را کاهش میدهند، باعث کاهش وزن حدود 1 کیلوگرم میشوند، در حالی که HbA1c را نیز کاهش میدهند، برخلاف سایر داروهای دیابت (از جمله انسولین) که باعث افزایش وزن میشوند. داروهایی که ترشح انسولین را در افراد بدون دیابت کاهش میدهند نیز باعث کاهش وزن میشوند. علاوه بر این، دو مطالعه جدید نشان می دهد که انسولین تنفس میتوکندری چربی در انسان را سرکوب می کند.
هال و همکاران اثر آگونیست های گیرنده GLP-1 را برای چاقی به عنوان شواهدی علیه CIM در نظر می گیرند، زیرا این اینکرتین به شدت ترشح انسولین تحریک شده توسط گلوکز را تقویت می کند. با این حال، GLP-1 سایر اقدامات بیولوژیکی مرتبط، از جمله کاهش سرعت تخلیه معده (که پاسخ گلیسمی را کاهش میدهد) دارد.
در واقع، آگونیستهای گیرنده GLP-1 بهطور مزمن میزان ترشح انسولین کل را کاهش میدهند، اگرچه مستقیم یا غیرمستقیم بودن این اثر هنوز مشخص نیست. در هر صورت، GL رژیم غذایی به شدت بر روی پروفایل ترشح اینکرتین تأثیر می گذارد و اینکرتین ها تأثیر مستقیمی بر حساسیت انسولین چربی دارند. به این دلایل، GLP-1 در مسیر علت اصلی در CIM قرار دارد
در مورد مهار لیپولیز، هال و همکاران به مطالعه ای اشاره کردند که هیچ اثری از acipimox (یک مشتق نیاسین است که به عنوان یک عامل کاهش دهنده چربی استفاده می شود. سطح تری گلیسیرید را کاهش می دهد و کلسترول HDL را افزایش می دهد) بر وزن انسان نشان نداد.
با این حال، این آگونیست گیرنده اسید نیکوتین دارای اقدامات بیولوژیکی است که تفسیر کارآزمایی ها را پیچیده می کند. آسیپیموکس ترشح هورمون ضد تنظیمی را افزایش می دهد، تجزیه پروتئین را تقویت می کند و باعث افزایش جبرانی اکسیداسیون گلوکز می شود. قابل ذکر است که مهار اکسیداسیون اسیدهای چرب با عوامل مختلف باعث تحریک مصرف غذا در حیوانات آزمایشگاهی و انسان می شود.
برای خلاصه کردن شواهد مربوط به این دو مدل، دادههای حیوانی نشان میدهند که رسوب بیش از حد چربی به وضوح میتواند از انرژی دریافتی جدا شود، که مخالف یک فرض اساسی EBM است. در مدلهای حیوانی که نه تنها شامل رژیم غذایی، بلکه مسیرهای مغزی در نظر گرفته شده برای دریافت غذا میشود، چاقی میتواند بدون افزایش مصرف غذا رخ دهد.
با این حال، دادههای انسانی محدودیتهای روششناختی عمدهای دارند که تا کنون مانع از آزمایش قطعی این دو مدل شدهاند. برای پیشرفت علم، مطالعاتی با مدت زمان کافی و طرحهای تکمیلی مورد نیاز خواهد بود، از جمله: (1) مطالعات تغذیه مکانیکی که قادر به تشخیص اثرات گذرا از مزمن درشت مغذیها هستند (≥1 ماه). (2) کارآزماییهای اثربخشی با شدت مداخله کافی برای ایجاد تغییر معنیدار رفتار بلندمدت (≥1 سال). و (3) مطالعات مشاهده ای طولی، که به طور ایده آل از دوران کودکی شروع می شود، در مورد تاریخچه طبیعی چاقی (≥10 سال).
ترجمه بالینی و پذیرش عمومی
هر دو طرف این بحث موافق هستند که تغییرات اساسی در محیط غذایی باعث همه گیری چاقی شده است. تمرکز EBM جدید بر روی چنین طیف وسیعی از فاکتورهای رژیمی(غذاهای همه جا حاضر، ارزان، راحت، پر انرژی، فوق فرآوری شده با حجم بالا، چربی و قند و پروتئین و فیبر کم) بینش عملی کمی را ارائه می دهد. توصیه ضمنی هال، برای اجتناب از غذاهای ناسالم، برای سالها مورد حمایت قرار گرفته است.
یکی از نگرانیهای خاص، روابط علتی با افزایش وزن مزمن برای فاکتورهای غذایی مورد هدف هال و همکاران به غیر از عواملی که مسیرهای مرتبط با CIM را نیز در بر میگیرند نشان داده نشده است. (مانند قند، که دارای GL و فروکتوز بالا است، فیبر، که باعث کاهش GI کربوهیدرات های مصرفی همزمان می شود؛ و پروتئین، که GI کربوهیدرات های مصرفی همزمان را کاهش می دهد و ترشح گلوکاگون را تحریک می کند. باقیمانده اهداف غذایی خاص EBM عبارتند از:
تراکم انرژی. تغییرات حاد در چگالی انرژی بر دریافت کوتاه مدت تأثیر می گذارد. به عنوان مثال، بل و همکاران به 18 زن در یک طرح متقاطع، رژیم های غذایی متفاوت از نظر چگالی انرژی، اما کنترل شده برای درشت مغذی ها، دادند. زنان در طول هر شرایط، حجم یکسانی از غذا مصرف کردند، که منجر به افزایش 31 درصدی در چگالی انرژی و 31 درصد افزایش انرژی دریافتی در شرایط با چگالی انرژی بالا در مقابل کم انرژی در طی 2 روز شد. هال و همکاران چندین مداخله و یک تحلیل مشاهده ای را برای پیشنهاد یک اثر مزمن مهم ذکر می کنند.
در یک مطالعه مداخله ای، به 97 زن مبتلا به چاقی توصیه شد که مصرف چربی را به تنهایی کاهش دهند یا مصرف چربی را کاهش دهند و میوه ها و سبزیجات با چگالی کم را افزایش دهند. پس از 1 سال، کسانی که تا پایان 1 سال از این روش پیروی کردند در گروه چگالی کم انرژی 1.5 کیلوگرم بیشتر از گروه مقایسه، وزن از دست دادند، اما اثر مربوط به کاهش بیشتر توده بدون چربی بود. گروه ها از نظر توده چربی کل یا دور کمر تفاوتی نداشتند.
در یک مطالعه مداخلهای دیگر، به 200 بزرگسال توصیه شد که از رژیمهای غذایی با محدودیت انرژی پیروی کنند و به برخی از آنها دستور داده شد که مقادیر متفاوتی از سوپهای کمانرژی در مقابل تنقلات جامد با چگالی بالا مصرف کنند. در اینجا دوباره، یک تفاوت متوسط در وزن بدن در 1 سال وجود داشت. با این حال، شرکتکنندگان در گروه میانوعده اقلام با GL بالا مصرف کردند (کراکر، چیپس سیبزمینی پخته شده، چیپس تورتیلا پخته، چیپس باگل، و چوب شور).
جای تعجب نیست که مصرف کربوهیدرات در این گروه بیشتر بود و هر گونه استنتاج علتی مرتبط را ممانعت کرد. علاوه بر این، در بزرگترین و طولانیترین کارآزمایی (n = 2718)، تفاوت معنیداری در چگالی انرژی بین گروههای مداخله به مدت 4 سال حفظ شد، بدون اینکه تاثیری بر انرژی دریافتی یا وزن بدن داشته باشد. با توجه به دادههای مشاهدهای در مورد چگالی انرژی، بس-راسترلو و همکاران نگرانیهای عمدهای در مورد مخدوشکردن و تعمیمپذیری را برجسته میکنند.
چربی رژیمی. مفروضات در مورد نقش چگالی انرژی در چاقی، به میزان زیادی باعث تمرکز بر کاهش چربی رژیم غذایی در توصیههای بهداشت عمومی از اواخر قرن بیستم شد. با این حال، رژیمهای غذایی کمچرب برای پیامدهای مرتبط با چاقی برتری نشان ندادهاند، و برخی از متاآنالیزها به این نتیجه میرسند که رژیمهای غذایی کمچرب برای کاهش وزن در مقابل رژیمهای پرچرب بیشتر برتری نداشتند. USDA عملاً کمپین بهداشت عمومی برای کاهش کل چربی رژیم غذایی را کنار گذاشته است.
فرآوری مواد غذایی. مصرف غذا در یک کارآزمایی 2 هفته ای با مصرف رژیم غذایی “فوق العاده فرآوری شده” در مقابل “غذای فرآوری نشده” بیشتر بود. با این حال، بر اساس یافتههای بل و همکاران، این اثر، افزایش 20 درصدی، به تنهایی به افزایش 85 درصدی در چگالی انرژی غیر نوشیدنی نسبت داده میشود.
بررسی سیستماتیک دادههای مشاهدهای توسط پوتی و همکاران نتیجهگیری میکند: «معلوم است که آیا ارتباط [با چاقی] را میتوان به فرآوری خود یا محتوای مواد مغذی غذاهای فوقفرآوریشده نسبت داد… و پتانسیل ایجاد مخدوشکننده باقیمانده بالا بود». همانطور که در جدول 3 نشان داده شده است، ترکیب درشت مغذی ها بر چگونگی تغییر در ماتریس و ساختار یک غذا تاثیر می گذارد که نشان می دهد مکانیسم های CIM توضیح بهتری برای ارتباط غذاهای فوق فرآوری شده با چاقی نسبت به EBM ارائه می دهد.
اگرچه افزایش مداوم در شیوع چاقی ممکن است ناشی از عدم پذیرش عمومی باشد تا هر گونه کمبود ذاتی خود EBM، نتایج درمان هدایت شده توسط EBM در طول قرن گذشته خلاف این را نشان می دهد. در سال 1959، روانپزشک و محقق چاقی، آلبرت (“میکی”) استانکارد به همراه ماویس مک لارن-هیوم یک مقاله مروری 30 ساله انجام دادند که قدمت آن به استفاده اولیه از کالری شماری برای کنترل وزن در دهه 1920 بازمی گردد.
آنها به این نتیجه رسیدند که نتایج میان گزارشها «بهطور قابل ملاحظهای مشابه و بهطور قابلتوجهی ضعیف» است و این نتایج «هرچند به نظر میرسد ضعیف هستند، با این حال [احتمالاً] بهتر از نتایج بهدستآمده توسط یک پزشک معمولی هستند». نویسندگان به صراحت به مفهوم تعادل انرژی پرداختند:
«سالها پیش به تفصیل مطالعات متابولیک مرگها نشان داد که انسانها از قانون ترمودینامیک سرپیچی نمیکنند و چربی بیش از حد بدن ناشی از دریافت بیش از حد کالری نسبت به مصرف کالری است. پس از آن، این یافته غیرمنطقی به عنوان این حکم مطرح شد که «تمام چاقی ها از پرخوری ناشی می شود»… به نظر می رسید کار پزشک صرفاً توضیح این بود که نیمه گرسنگی (semistarvation) ذخایر چربی را کاهش می دهد، برای این منظور رژیمی تجویز می کرد و کنار می ماند.
اگر بیمار همانطور که پیشبینی شده بود وزن کم میکرد، این فقط این احساس راحت را تأیید میکرد که درمان چاقی واقعاً یک موضوع بسیار ساده است. با این حال، اگر، همانطور که اغلب اتفاق میافتاد، بیمار نتوانست وزن کم کند، او را بهعنوان غیرهمکار یا بهعنوان پرخور مجازات میکردند. این پزشک نادری بود که این احتمال را داشت که عدم پیروی از یک رژیم ممکن است به خودی خود یک مشکل پزشکی باشد.
در سال 1992، مؤسسه ملی بهداشت از کنفرانس توسعه اجماع در مورد روشهای کاهش و کنترل وزن داوطلبانه حمایت کرد که شامل بسیاری از متخصصان برجسته در زمینه چاقی بود. در آن زمان، محدودیت چربی در رژیم غذایی “بهترین وسیله برای دستیابی به وزن سالم … ترجیح داده می شد، زیرا خوردن کالری کمتر بدون نیاز به خوردن وعده های کوچک آسان تر است”، دیدگاهی که اغلب در بررسی های آکادمیک معاصر مورد حمایت قرار می گیرد.
با این حال، کنفرانس اجماع شواهد کمی پیدا کرد که نشان دهد درمان چاقی نتایج بسیار بهتری نسبت به مواردی که توسط استانکارد و مک لارن-هیوم بررسی شده بود به دست آورد. نتایج کنفرانس به این نتیجه رسید که «شرکتکنندگانی که در برنامههای کاهش وزن باقی میمانند معمولاً تقریباً 10 درصد وزن خود را از دست میدهند. [بسیاری از] وزن در عرض 1 سال دوباره به دست میآید و تقریباً تمام آن در عرض 5 سال دوباره به دست میآید».
علاوه بر این، تحلیل مظفریان شواهد کمی ارائه میدهد که نشان میدهد، در دهههای اخیر، آمریکاییها به توصیه بنیادی «کمتر خوردن» EBM، حداقل بر اساس جمعیت، پایبند بودهاند – حتی با ادامه افزایش نرخ چاقی.
از نظر بدیهی، درمان بیماری متمرکز بر محرکهای علتی (بالا دست در امتداد مسیر مکانیکی) باید برای بیمار مؤثرتر و پایدارتر از درمانهایی باشد که پیامدها و تظاهرات پایین دست را هدف قرار میدهند. اگر بر اساس قیاس، تب به عنوان یک اختلال در «تعادل گرما» در نظر گرفته شود، ممکن است به طور منطقی یک دوش آب سرد برای کاهش دمای بدن تجویز شود. این درمان به طور موقت جواب می دهد (اگر بتوان یک بیمار تب دار را متقاعد کرد که آن را امتحان کند)، اما بدن از دست دادن گرما را با لرز شدید و انقباض عروق خونی جبران می کند. هنگامی که بیمار از دوش آب سرد خارج می شد، تب برمی گشت.
داروهای ضد تب با پرداختن به محرک بیولوژیکی تجمع گرما به طور موثرتر و خوشایندتر برای بیمار عمل می کنند. به طور مشابه، اگر چاقی ناشی از اختلال در پارتیشن بندی سوخت باشد، اقداماتی برای درمان آن مشکل (مثلاً با کاهش نسبت انسولین به گلوکاگون) به پایبندی بهتری نسبت به محدودیت کالری دست خواهد یافت، زیرا بیمار گرسنگی کمتر و کاهش کمتری را در مصرف انرژی با کاهش وزن تجربه خواهد کرد.
تقابل پارادایم درهم آمیخته
حفظ تضاد بین این مدلهای رقیب برای شفافسازی تفکر، اطلاعرسانی یک دستور کار تحقیقاتی و شناسایی ابزارهای موثر پیشگیری و درمان حیاتی است. هال و همکاران این تضاد را با تنزل دادن CIM به “یک مورد خاص” از EBM در هم میریزند. این ادعا بنیادی ترین تفاوت های ممکن را بین مدل ها رد می کند: جهت علتی و مکانیسم های علیت (شکل 1). قرار دادن CIM به این شکل مستلزم تفسیر EBM به قدری گسترده است که آن را غیرقابل ابطال و در نتیجه به عنوان یک فرضیه علمی بی فایده می کند. همانطور که کارل پوپر گفته است، “نظریه ای که همه چیز را توضیح می دهد، هیچ چیز را توضیح نمی دهد.”
هال و همکاران همچنین ادعا میکنند که CIM قوانین اساسی را کنار گذاشته است، و با اشاره به فرمولهای قبلی «چربیمرکزی» گفته میشود که فقط اعمال انسولین در بافت چربی را در نظر میگیرد. با این حال، این توصیف توسط طرفداران CIM انجام نشده است و یک تمایز نادرست ارائه می دهد. کنترل بیولوژی بافت چربی توسط چندین اثر هورمونی، اتونومیک و سایر عوامل برای چندین دهه شناخته شده است. در واقع، اقدامات فیزیولوژیکی رژیمهای غذایی با GL و قند بالا مدتهاست که شامل روابط یکپارچه بین اندامهای متعدد فراتر از بافت چربی و هورمونهای متعدد فراتر از انسولین است.
این نگرانی در مورد بازنگری CIM در تضاد با اذعان آنهاست که توسعه EBM همچنان مستلزم روشن شدن عواملی در محیط پویای غذایی است که بیشترین مسئولیت را در ایجاد چاقی دارند و مکانیسم هایی که توسط آن این عوامل مدارهای مغزی کنترل کننده دریافت غذا را تغییر می دهند. در واقع، اهداف رژیم غذایی توصیههای مبتنی بر EBM از شمارش کالری در اوایل قرن بیستم به تمرکز فراگیر بر روی محدودیت چربی رژیم غذایی در اواخر قرن بیستم تغییر کرده است، و این تصور که همه کالریها شبیه هم هستند، به فرمول جدید، که فراتر از کالری دریافتی و کالری مصرفی است، اکنون تعداد زیادی از عوامل رژیم غذایی مدرن را مقصر میداند. برای اینکه مدلهای علمی مرتبط باقی بمانند، باید همزمان با افزایش دانش رشد کنند.
حتی همانطور که هال و همکاران از منشأ CIM انتقاد می کنند، EBM آنها دارای کاستی های عمده ای است، از جمله:
فقدان فرضیه های صریح قابل آزمون.
مراحل کلیدی در طول مسیر علتی چگونه مورد بازجویی قرار می گیرند؟ چه مطالعاتی مسیر علتی پیشنهادی را (پرخوری باعث افزایش مزمن وزن میشود) از فرضیه متضاد در CIM متمایز خواهد کرد؟ هنگامی که انسان یا حیوانات به طور تجربی بیش از حد تغذیه می شوند، در ابتدا وزن آنها افزایش می یابد. اما تغییرات در گرسنگی و مصرف انرژی مخالف تغییر وزن مداوم است. پس از پایان تغذیه اجباری، افراد به طور مشخص تا زمانی که وزن بدن به حالت اولیه بازگردد، کم می خورند. به عبارت دیگر، انرژی اضافی وارد شده به بافت چربی در جای خود باقی نمی ماند، اما توده چربی اضافی که در طول زمان در رژیمهای غذایی معمولی انباشته شده است، بهطور قابلتوجهی پایدار میماند.
توتولوژی ها
هال و همکاران در حالی که استدلال می کنند که مخالفان EBM فیزیک را با پاتوفیزیولوژی اشتباه می گیرند. ادعا می کند که “EBM مکانیسم های فیزیولوژیکی زیربنایی تقسیم انرژی را شامل می شود … به طوری که عدم تعادل کلی انرژی در درجه اول به عنوان عدم تعادل چربی بدون توجه به ترکیب رژیم منعکس می شود.” آنها همچنین ادعا می کنند که “عدم تعادل چربی کل بدن در درجه اول به عنوان تغییر در ذخیره سازی چربی بافت چربی منعکس می شود.” آنها با این کار این سردرگمی را تبلیغ می کنند. همانطور که در بالا در نظر گرفته شد، قانون بقای انرژی معتقد است که تغییر در تعادل انرژی باید با تغییر متناسب در توده چربی و بافت چربی (به ترتیب زیست مولکول و انبار اصلی ذخیره انرژی بدن) وجود داشته باشد. این توتولوژی ها هیچ بینش مکانیکی ارائه نمی دهند.
کمبود مکانیسمهای مربوط به اجزای اصلی مدل.
چگونه EBM جدید افزایش سریع وزن در سطح جمعیت و تغییرات زیاد در افراد در طول زمان را توضیح می دهد؟ متغیرهای فیزیولوژیکی تنظیم شده (مانند دمای بدن، سدیم سرم) با ثبات مشخص می شوند مگر در شرایط شدید. چه مطالعاتی میانجی های احتمالی (مانند پاداش، تأثیرات لذت جو) را از میانجی های موجود در CIM (پاسخ هورمونی به ترکیب درشت مغذی) متمایز می کند؟ علاوه بر این، اگر واکنشهای مرتبط با لذت به غذاهای خوش طعم باعث مصرف بیش از حد مزمن میشود، چرا نشان دادن تأثیر مستقل خوشمزه بودن بر چاقی دشوار بوده است؟
نادیده گرفتن مکانیسم های متابولیک به خوبی تثبیت شده.
برای افراد چاق، محدودیت انرژی نشانههای واکنش گرسنگی (از جمله کاهش مصرف انرژی) را مدتها قبل از رسیدن ذخایر چربی بدن به سطح طبیعی ایجاد میکند. جنبه های لذت بخش و پاداش غذای خوش طعم چگونه پاسخ های متابولیکی را تحریک می کنند؟
مشکل در محاسبه تاریخچه طبیعی چاقی.
اکثر اشکال چاقی در طی سالیان متمادی ایجاد میشوند که با تعادل انرژی مثبت حدود 10 تا 20 کیلوکالری در روز (محتوای انرژی در 1 قاشق چایخوری شکر) همراه است. افزایش سکولار در دریافت انرژی از سال 1970 تا کنون در ایالات متحده حدود 200 کیلوکالری در روز (12 اونس آب انگور) است. با توجه به بار روانی اجتماعی و سایر بارهای اضافه وزن، چرا تعداد کمی از افراد با کنترل آگاهانه این اثرات کوچک روزانه را با موفقیت جبران می کنند؟ به هر حال، بزرگسالان به طور معمول در برابر وسوسههای لذتبخش (مانند رابطه جنسی، مواد مخدر) که انگیزههای ناخودآگاه را نیز به خدمت میگیرند، مقاومت میکنند؟
تکیه بر مفروضاتی که بین مدل ها تفاوتی قائل نمی شوند. EBM جدید شواهدی را که نشان میدهد مغز وزن بدن را کنترل میکند، تفسیر میکند که نقش علّی پرخوری در چاقی را پشتیبانی میکند. همانطور که در بالا در نظر گرفته شد، مغز تقریباً بر تمام جنبه های متابولیسم انرژی و زیست شناسی چربی تأثیر می گذارد.
نتیجه گیری
برای مشکلات غیرقابل حل بهداشت عمومی، هدف مدل های علمی هدایت طراحی تحقیقات آموزنده و با کمک به روشن ساختن مکانیسم های علّی، پیشنهاد رویکردهای مؤثر برای پیشگیری یا درمان است. EBM جدید هیچ کدام را انجام نمی دهد. حداقل، فرمولهای آینده باید (1) پیشبینیهای قابل آزمایش و مکانیکی جهتگیری را مشخص کنند که مسیر علتی را بررسی میکنند. (2) توضیح دهید که چرا افزایش BMI در سطح جمعیت توسط پاسخ های متابولیکی دفاع می شود. و (3) نشان دهد که چگونه اثرات رژیم غذایی مستقل از کالری پیشنهاد شده توسط تحقیقات بالینی و نشان داده شده توسط مدل های حیوانی می تواند در این مدل ادغام شود.
EBM و پیش سازهای آن برای نزدیک به یک قرن بر تفکر تسلط داشته اند – تأثیر بر طراحی علمی، تفسیر یافته های تجربی، دستورالعمل های بهداشت عمومی و درمان بالینی – عمدتاً به استثنای دیدگاه های دیگر. برای مثال، NIH آزمایشهای چندمرکزی متعددی را از رژیمهای غذایی کمچرب برای پیامدهای مرتبط با چاقی (همه با پیامدهای اولیه منفی) حمایت کرده است، اما هیچ چیز قابل مقایسه با رژیمهای غذایی با GL پایین نیست. با ناتوانی استراتژیهای مرسوم در جلوگیری از افزایش تلفات بیماریهای مرتبط با چاقی، مدلهای علّی جدید باید مورد مطالعه قرار گیرند، نه اینکه با ادعاهای هذل آمیز مبنی بر رد آنها سرکوب شوند.
مسلماً، بحث در مورد سؤالات علمی پیچیده ممکن است قطبی شود، با تمایل هر دو طرف به استناد گزینشی از شواهد غیرقطعی. این مشکل به دلیل مشکلات در مطالعه اثرات کوچک روزانه که مشخصه تاریخ طبیعی چاقی است تشدید می شود. به نفع پیشرفت علمی و سلامت عمومی، همه طرفهای این بحث باید با یکدیگر همکاری کنند تا نسخههای قابل قبولی از مدلهای رقیب را تدوین کنند و مطالعات بیطرفانهای طراحی کنند که آنها را در معرض آزمایشی سخت قرار دهد. یک تضاد پارادایم سازنده ممکن است با تشخیص این که شواهد برای یک مدل در تنظیمات تجربی خاص، مدل دیگر را در همه تنظیمات باطل نمی کند، و اینکه پاتوژنز چاقی در انسان ممکن است مستلزم عناصر هر دو باشد، تسهیل شود.
در نهایت، ما تأکید می کنیم که این تضاد پارادایم نباید اقدام بهداشت عمومی را به تأخیر بیندازد. غلات تصفیه شده و قندهای افزوده شده حدود یک سوم انرژی دریافتی در ایالات متحده و اروپا را تشکیل می دهند. هر دو مدل این کربوهیدراتهای بسیار فرآوری شده را – البته به دلایل مختلف – به عنوان محرکهای اصلی افزایش وزن هدف قرار میدهند. صرف نظر از اینکه چگونه این بحث ممکن است تکامل یابد، اکنون نقاط مشترکی در مورد نیاز به جایگزینی این محصولات با کربوهیدرات های فرآوری شده یا چربی های سالم در پیشگیری و درمان چاقی وجود دارد.











